Cục Quản lý dược (Bộ Y tế) vừa có công văn gửi sở y tế các tỉnh, thành phố trực thuộc Trung ương về thuốc giả Cefixime 200.
Trước đó, Trung tâm Kiểm nghiệm tỉnh Thanh Hóa đã lấy mẫu sản phẩm tại Công ty cổ phần dược phẩm Hưng Thịnh (huyện Nga Sơn, tỉnh Thanh Hóa). Sản phẩm có các thông tin ghi nhãn: Viên nén bao phim Cefixime 200 (số giấy đăng ký lưu hành: VD-28887-18, số lô: 15030723, ngày sản xuất: 3/7/2023, hạn dùng: 3/7/2025, nơi sản xuất: Công ty cổ phần dược phẩm Cửu Long). Kết quả, mẫu thuốc không đạt yêu cầu chất lượng về chỉ tiêu định tính Cefixim.
Sau đó, Cục Quản lý Dược nhận được công văn của Trung tâm Kiểm nghiệm tỉnh Bình Dương, gửi kèm Phiếu Kiểm nghiệm báo cáo về việc mẫu sản phẩm có các thông tin ghi nhãn: Viên nén bao phim Cefixim 200, số GĐKLH: VD-28887-18, số lô: 28201123, NSX: 201123, HD: 201125, nơi sản xuất: Công ty Cổ phần Dược phẩm Cửu Long.
Trung tâm Kiểm nghiệm tỉnh Bình Dương cũng đưa ra thông báo kết quả kiểm nghiệm mẫu sản phẩm có các thông tin ghi nhãn: Viên nén bao phim Cefixime 200 (số giấy đăng ký lưu hành: VD-28887-18, số lô: 28201123, ngày sản xuất: 20-11-2023, hạn dùng: 20-11-2025, nơi sản xuất: Công ty cổ phần dược phẩm Cửu Long). Mẫu thuốc lấy tại quầy thuốc tây Thanh Duy (địa chỉ huyện Bàu Bàng, tỉnh Bình Dương). Mẫu thuốc cũng không đạt yêu cầu chất lượng về chỉ tiêu định tính cefixim.
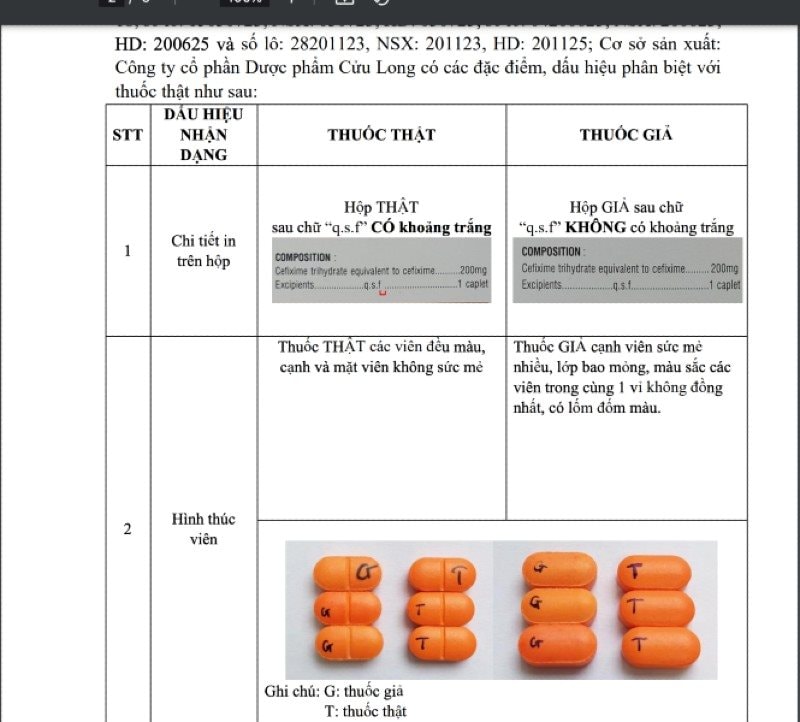
Ngày 23/7, Công ty cổ phần dược Cửu Long đã có báo cáo việc sản xuất các lô thuốc Cefixime 200 và dấu hiệu khác biệt giữa mẫu thuốc lưu tại công ty và mẫu thuốc do Trung tâm Kiểm nghiệm tỉnh Thanh Hóa thu được trên thị trường
Sau khi đối chiếu, xem xét, để bảo đảm an toàn cho người sử dụng, Cục Quản lý dược đề nghị sở y tế các tỉnh, thành phố trực thuộc Trung ương, y tế các ngành thông báo cho các cơ sở kinh doanh, sử dụng thuốc thông tin về thuốc giả trên nhãn ghi: Viên nén bao phim Cefixime 200 (số giấy đăng ký lưu hành: VD-28887-18; số lô: 15030723, ngày sản xuất: 03/7/23, hạn dùng: 03/7/2025, số lô: 04200623, ngày sản xuất: 20/6/2023, hạn dùng: 20/6/2025 và số lô: 28201123, ngày sản xuất: 20/11/2023, hạn dùng: 20/11/2025; cơ sở sản xuất: Công ty cổ phần dược phẩm Cửu Long).
Theo đó, Cục Quản lý dược đề nghị sở y tế các tỉnh, thành phố phối hợp với các cơ quan truyền thông, thông tin tới các cơ sở buôn bán, sử dụng thuốc và người dân biết để không buôn bán, sử dụng sản phẩm Cefixime 200 giả có các dấu hiệu nhận biết nêu trên. Người dân chỉ mua bán thuốc tại các cơ sở kinh doanh dược hợp pháp; không mua bán thuốc không rõ nguồn gốc và kịp thời thông báo các dấu hiệu nghi ngờ về sản xuất, kinh doanh thuốc giả, thuốc không rõ nguồn gốc tới cơ quan y tế và cơ quan có chức năng liên quan.
Các đơn vị phối hợp kiểm tra các cơ sở kinh doanh thuốc trên địa bàn; điều tra, xác minh thông tin và truy tìm nguồn gốc về sản phẩm Cefixime 200 giả nêu trên, xử lý các tổ chức, cá nhân vi phạm theo quy định hiện hành; kịp thời phát hiện và ngăn chặn việc sản xuất, buôn bán và sử dụng thuốc giả.